講演4 AIを用いた循環器予防 現状と未来
東京科学大学大学院医歯学総合研究科循環制御内科学教授
笹野 哲郎 先生
AIの歴史と医療におけるAI
「計算する機械と知性」の研究は1950年から始まりました。AIという言葉が初めて使われたのは1956年のダートマス会議です。ジョン・マッカーシー教授によって、「知的な機械、特に知的なコンピュータ・プログラムを作る科学と工学」としてAIという言葉が使われました。これが第一次ブーム(1956~1970年:推論・探索)ですが、その後、第二次ブーム(1980~1995年:知識表現)、第三次ブーム(2010年~:機械学習・表現学習)と続き、現在では第四次ブーム(2023年~:生成AI)が到来しています1)。医療ではデジタルデータをインプットすることで、AIを色々な学習モデルを使って疾患の発症予測や自動診断などに使っています2)。
医療におけるAIについて心電図を例にとって紹介しますと、一つは自動診断であり、私たちが目で見て診断できることを代わりにAIが行うということです。もう一つは、心疾患の有病予測や不整脈発作の予測など、私たちが目で見てもわからないことを行ってくれるということです。心疾患早期発見・再発予測のために病院で施行するデバイスとしては、現在、長時間ホルター心電計、弁膜症推定機能つきデジタル聴診器、心不全再発予測機能つき心電計、心電計つき血圧計などの医療機器があります。一方、家庭で施行するものとしてはスマートウォッチ、スマートリングなどのヘルスケア機器があります。これらの一部にはAIが応用されています。
心房細動診療におけるAI
ここからはAIの対象疾患を心房細動に限定して話を進めます。本邦における心房細動患者数は約100万人と言われていますが、心房細動患 の有病率は高齢化とともに上がりますので3)、高齢化が進む社会とともに心房細動患者数はさらに増加すると予想されます。
心房細動は脳梗塞、心不全、認知機能低下などを合併することが知られていますが、坑凝固薬投与やカテーテル・アブレーションなどで治療ができる疾患です。問題は診断であり、「隠れ心房細動」が存在することです。「隠れ心房細動」の患者数は推定100万人以上で、動悸などの症状があっても、病院受診時に心房細動発作が消失していると診断にいたりません。しかも心房細動発作時に自覚症状がない人が約40%いるとされています。「隠れ心房細動」では治療を受けておらず、脳梗塞リスクは高くなります。原因不明の脳梗塞の方に4週間心電図記録を行うと、その14.8%に未診断の心房細動がありました4)、また心原性脳塞栓による入院例で、入院前に心房細動と診断されていなかった患者の割合は45.9%5)、などの報告があります。
このような状況に対応すべく、私たちは「12誘導心電図の深層学習解析」に着手しました。患者さんの12誘導心電図をAIに学習させて発作性心房細動を予測させようというものですが、開始した7~8年前の少数例でのモデルの予測精度は64%ほどでした。AIのデータは数が力なので、その後、モデル改善のために心電図データを協力病院からも収集しました(2020年3月~2022年4月、東京医科歯科大学、自治医科大学を含む全7施設)。症例数は発作性心房細動群(発作性心房細動が心電図で検出され、循環器内科を受診している患者:1,350例)、対照群(循環器内科に通院しており、反復する心電図検査で心房細動が認められない患者:1,350例)。このようにして「12誘導心電図の深層学習による発作性心房細動推定」の精度を高め、心電図の自動診断結果の画面の横に、「隠れ心房細動リスク推定」も表示されるようにしました。これは昨年、医療機器承認を得て発売されました。しかし、この学習データは心血管患者から得られたものなので、健常者を対象としても同等の性能が出るかについては不明です。
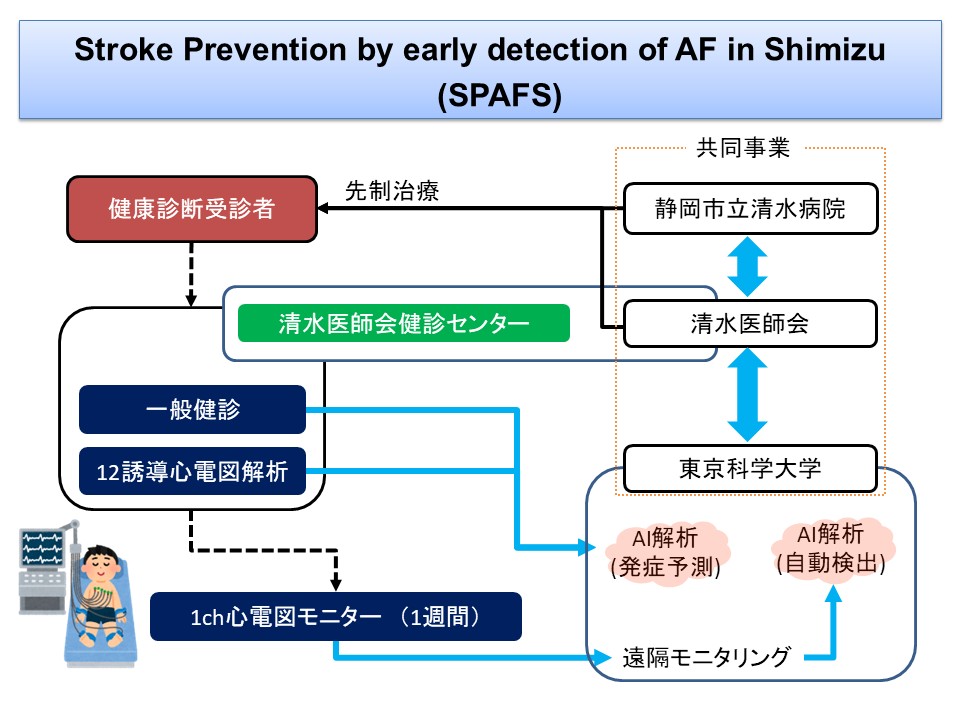
そこで、次にこれが健診で使えるかどうかを検討しました。「AI及びリモートテクノロジーを用いた心房細動の早期発見により清水区を脳梗塞の少ないまちにする地域医療プロジェクト」(Stroke Prevention by early detection of AF in Shimizu: SPAFS=エスパフス)は静岡市との共同研究であり、第4次静岡市総合計画にも入っています。これは健康診断受診者に12誘導心電図検査を受けてもらいAI解析(発症予測)を行い、その後、全員に1チャンネル心電図モニターを1週間つけてもらい、遠隔モニタリングによりAI解析(自動検出)をするものです(図1)。2022年から開始しましたが、2023年7月までの結果では、362例の参加者(心房細動例を除く)のうち11例に「隠れ心房細動」を発見することができました。この362例では、AI心電図による心房細動予測判定を3段化にしましたが、その分布をみると、「低い」が70%弱を占め、「中等度」「高い」と続きました。1週間ホルター心電図による心房細動検出率は、対象を65歳以上に限定すると各々、2.1%、7.2%、12.0%とAI心電図で「心房細動のリスクが高い」と出た例の検出率が高くなりました6)。全年齢でも同様の傾向を認めましたが、65歳以上で検出率が高くなりました。1年後の2024年7月に904例を対象とした解析では、AI心電図による心房細動予測判定の分布に同様の結果が得られましたが、1週間ホルター心電図による心房細動検出率はやや低下しました(65歳以上では各々、0.8%、5.1%、6.7%)。この結果を踏まえて、AI心電図で「低い」と判定された場合は、その後、清水区の健診ではホルター心電図は行わないこととしました。
図1 Stroke Prevention by early detection of AF in Shimizu(SPAFS)
AI心房細動健診の課題
このような「AI心房細動健診」を開始したことで、課題もいくつか出てきました。一つは「市民への周知」です。そのために静岡市長と共に公開市民講座を行ったり、地元のサッカーチーム「清水エスパルス」(清水区でのプロジェクト名「エスパプス」は「清水エスパルス」由来)に協力してもらい、試合する球場に行ってバナー(旗/横断幕)をかざして受診を広報したりしました。もう一つは「AI判定」の精度の問題です。心電図で評価可能な不整脈リスクには、静的要因(12誘導心電図による:10秒)・変動要因(12誘導心電図による:2~15分)・トリガー興奮(ホルター心電図による:長時間)などがありますが、AI心電図で見ているのは静的要因だけです。そこでAI心電図による心房細動有病予測の留意点として、①基本的には心房細動基質の評価をしており、他の要素は見ていない、②基質自体にも変動性がり、AI判定にも変動が出ることがある、③電極装着位置が異なるとAI判定の結果が変わる、などを挙げることができます。
最近ではAIを絶対視する傾向が強まっていますがAIは神様ではありません。心電図AIはリスク評価の一部であって、リスク評価には他にも色々なものがあり、それらも重要です。ゲノム情報もその一つです。心房細動には遺伝性があり、心房細動と関連する遺伝子多型が数多く報告されており、遺伝子多型を用いたリスク評価も提唱されています。遺伝子多型単独だと心房細動リスク評価の精度はさほど高くありませんが、AI心電図と遺伝子多型(4段階のボリジェニックリスクスコア)を組み合わせるとリスク評価の精度が上がってくることがわかりました7)。現在、東京都の大学研究者事業提案制度「寝たきりを20%減らすAI心房細動健診」として、このAI心電図と遺伝子解析を統合した心房細動の有病予測を活用し、さらにウエアラブル機器によるAIモニタリングにより心房細動を診断して先制医療を行う事業を2024年度から開始しました。
必要とされる健康意識に応じたスクリーニング
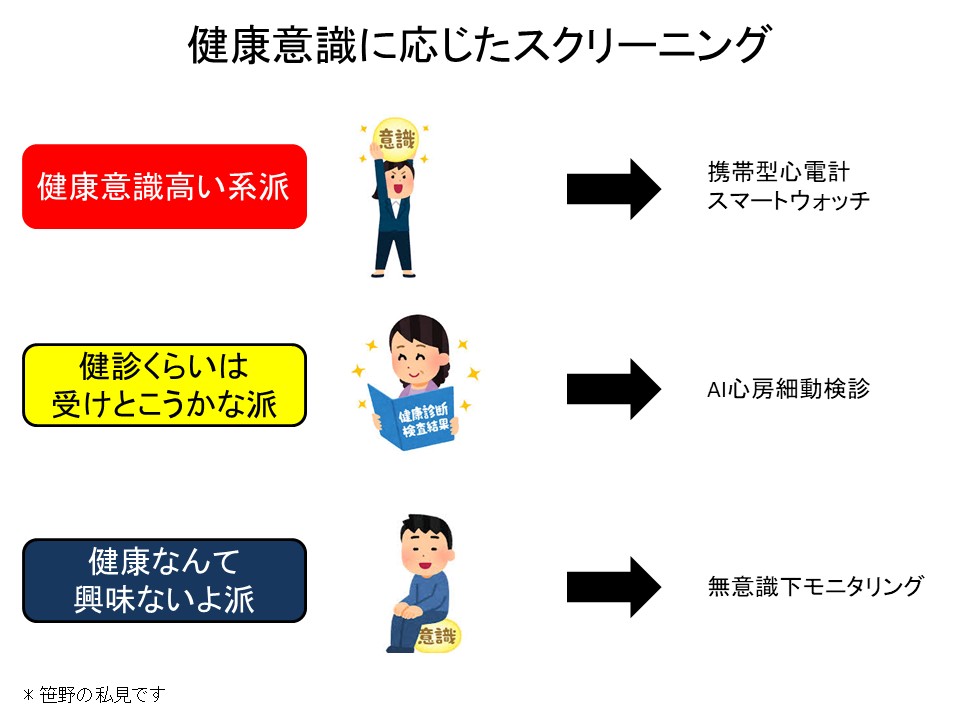
私見ですが、人は、①健康意識高い系派、②健診くらいは受けとこうかな派、③健康なんて興味ないよ派、の3種類に分かれるのではないでしょうか。このような意識の在り方(ウエアラブル機器への親和性で評価)と心房細動リスクには関係があって、①の健康意識高い系派は健康管理に気をつけているのでリスクが低いといえます。②の健診くらいは受けとこうかな派はいろんなリスクの方が含まれており、検診を積極的に受けるよう働きかけることができますし、実際にそれが進められています。問題は③の健康なんて興味ないよ派であり、これらの方は潜在的にリスクは高いと思われます。こういう人たちのために考えられているのが、無意識下でもスクリーニングできるような方法です。いくつかの手法を検討しておりますが、その一つとして、「心弾動図による心拍の検出」を行っています(図2)。人体は呼吸および心拍により振動波が出ています。この振動をセンサで検知し、心拍成分を検出することができます。これは心弾動図と呼ばれ、昔から行われていた方法ですが、AIを使った機械学習により心房細動の推定精度が上がりました8)。現在、カプセルホテルとの共同研究を始めており、カプセルホテル内における睡眠状況のデータを用いて、不整脈検出の手法確立を目指しています。カプセルホテル内にはセンサが敷いてありますので、チェックイン時に検査の同意を得た上で、チェックアウト時に睡眠時の心房細動の有無を知らせて、必要な人を心電図検査におもむかせることができます。この方法では、能動的に検診に来ていただく必要がないのが特徴です。このように健康意識に応じたスクリーニングによって、幅広く隠れ心房細動を検出していくことが重要と思われます(図3)。図2 心弾動図による心拍の検出
Hamada S,et al.: 文献8)

図3 健康意識に応じたスクリーニング
私見
AIによる有病予測
AIによる有病予測は、ブルガダ症候群にも使うことができます。ブルガダ症候群は20~40歳代の男性に多いのですが、日本を含む東アジアで有病率が高く、夜間の心室細動発作で突然死する危険性があります。しかし従来の心電図ではそのリスク評価は難しいのです。AI心電図(12誘導心電図の深層学習による突然死リスク推定)を使うと、ある程度の精度で予測できますが9)、心室性不整脈による突然死の可能性が高いと判定されても対応に困ることになります。家庭にAED(自動体外式除細動器)を置いておくといった対応はできると思いますが、ICD(植込み型除細動器)を植え込むまではまだ行きません。それはAIにそこまでの説明性がないからです。つまり、AI心電図による有病予測は、確定診断の手段があり治療法がある疾患に一番有効ということになります。AI心電図による心疾患有病予測の現状と注意点としては、①精度、②説明性、③汎用性・頑健性、④結果の解釈と指導、などが挙げられます。今後、AI心電図による有病予測は様々な心疾患に広がっていくと思いますが、それぞれの心疾患に応じて慎重に使用していく必要があると考えられます。AI標準12誘導心電図では、年齢・性別を推定することも可能であり10)、心電図年齢と実年齢のギャップが大きいことは死亡リスクに繋るとされています11)。現在、脈波伝播速度などから血管年齢を推定する手法がありますが、同様に心電図年齢を健康管理に用いる時代も来ることが予想されます。最後に本日の講演のサマリーを示します(表1)。
表1 本日のサマリー

参考文献
1)埼玉県Ai情報サイト(製造業向き).公益財団法人埼玉県産業振興公社 DX推進支援グループ(https://dxconso.com/) AIとは2)Nakamura T,Sasano T,J Cardiol 2022:79:326-333
Graphical abstract
3)Inoue H,et al.:Int J Cardiol 2009;137:102-107
4)Gladstone DJ,et al.:N Engl J Med 2014;370:2467-2477
5)Nakamura A,et al.:Cerebrovasc Dis 2016;42:196-204
6)Masumura M,et al.:J Arrhythm 2025;41 e70132
https://doi.org/10.1002/joa3.70132
7)Ihara K,et al: JACC Asia (in press)
8) Hamada S, et al Sensors (in press)
9)Nakamura T,et al.:Circ J 2023;87:1007-1014
10)Attia ZI,et al.:Circ Arrhythm Electrophysiol 2019;12:e007284
https://doi.org/10.1161/CIRCEP.119.007284
11)Ladejobi AO,et al.:Eur Heart J Digital Health 2021:2:379-389
https://doi.org/10.1093/ehjdh/ztab043